2013년02월23일 20번
[자연과학개론] 일정한 온도에서 A(g) + B(g) → 2C(g) 반응의 실험을 수행하였다. 그림(가)는 [B]0 ≫ [A]0 일 때 시간에 따른 [A]를, (나)는 [A]0 ≫ [B]0 일 때 시간에 따른 1/[B]를 나타낸 것이다. [A]0와 [B]0는 각각 A와 B의 초기 농도이다.
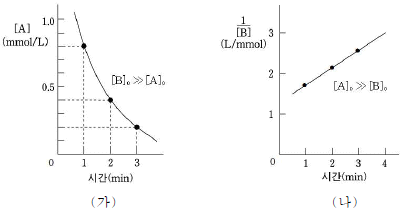
이에 대한 설명으로 옳은 것은?

이에 대한 설명으로 옳은 것은?
- ① A의 반감기는 2분(min)이다.
- ② B에 대하여 1차 반응이다.
- ③ B의 반감기는 B의 농도에 반비례한다.
- ④ C의 생성 속도는 A의 소멸 속도의 1/2 이다.
- 전체 반응의 반응 차수는 2이다.
(정답률: 알수없음)
문제 해설




반감기는 반응 속도 상수와 관련이 있다. 1차 반응에서 반감기는 ln2/k로 계산된다. 따라서 B의 반감기는 1차 반응이므로 B의 농도에 반비례한다. 이는 반응 속도 상수가 B의 농도에 비례하기 때문이다.